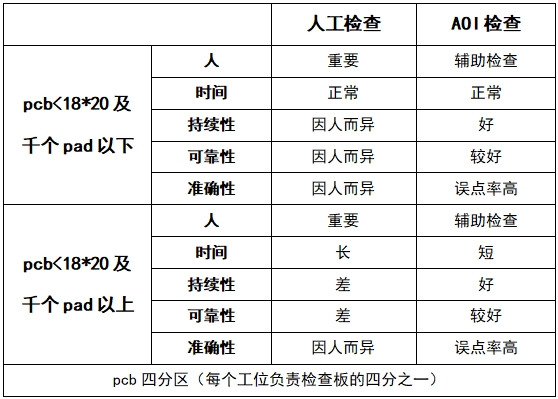
燃料电池原理
燃料电池是一种能量转化设备,它是按电化学原理,即原电池作业原理,等温的把贮存在燃料和氧化剂中的化学能直接转化为电能,因而实践进程是氧化复原反响。燃料电池主要由四部分组成,即阳极、阴极、电解质和外部电路。燃料气和氧化气分别由燃料电池的阳极和阴极通入。燃料气在阳极上放出电子,电子经外电路传导到阴极并与氧化气结合生成离子。离子在电场效果下,经过电解质迁移到阳极上,与燃料气反响,构成回路,发作电流。一起,因为自身的电化学反响以及电池的内阻,燃料电池还会发作必定的热量。电池的阴、阳南北极除传导电子外,也作为氧化复原反响的催化剂。当燃料为碳氢化合物时,阳极要求有更高的催化活性。阴、阳南北极一般为多孔结构,以便于反响气体的通入和产品排出。电解质起传递离子和别离燃料气、氧化气的效果。为阻挠两种气体混合导致电池内短路,电解质一般为细密结构。
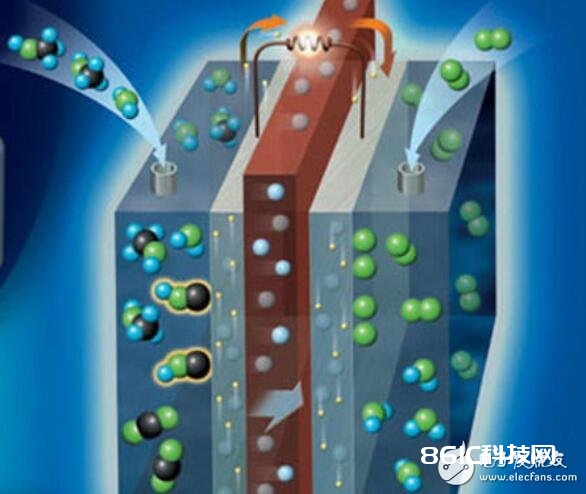
燃料电池方程式常识汇总
燃料电池的电极反响(主要是负极的电极方程式)是一个难点。咱们知道,一般的燃料电池大多是可燃性物质(主要是可燃性气体)与氧气及电解质溶液一起组成的原电池,尽管可燃性物质与氧气在不同的电极反响,但其总反响方程式是可燃物在氧气中焚烧。
因为触及电解质溶液,所以焚烧产品或许还要与电解质溶液反响,再写出焚烧产品与电解质溶液反响的方程式,然后得到总反响方程式。因为在反响中氧气由0价变为-2价,所以肯定是O2得电子,即O2作氧化剂是正极,即可写出正极的电极反响式:O2+4e+2H2O=4OH_①(该反响式为常见的绝大多数燃料电池的正极反响式)。
若此刻电解质溶液为酸性,则反响进程能够理解为:正极上首先发作:O2+4e-=2O2-因为在酸性环境中很多存在H+故O2-会与H+结组成H20,故正极反响式应为:O2+4e-+4H+=2H2O②
若电解质为中性或碱性时,则正极反响式就仅仅①。此刻负极反响式就可由总电极方程式减去正极的电极方程式得到(留意要将方程式中的氧气抵消掉)。
(1)直接法书写电极反响式:(以氢氧燃料电池为例)
解析:H2、O2燃料电池中反响本质为:2H2+O2=2HO
电极上H2-2e-=2H+O2+4e-=2O2+
在不同环境中H+、O2-会与电解质发作不同的反响,故电极反响也相应不同:
①、酸性环境中:H+能安稳存在,O2-会与H+结组成H20,
负极:2H2-4e-=4H+正极:O2+4H++4e-=2H2O
②、碱性环境中:H+不能安稳存在会与OH-结组成水,而O2-也不能安稳存在会与水结合构成OH-
负极:2H2-4e-+4OH-=4H20正极:O2+2H2O+4e-=4OH-
③、中性环境中:H+能安稳存在:02-会与H20结组成OH-:
负极:2H2-4e-=4H+正极:O2+2H20+4e-=4OH-
④、在能传导O2-的固体电解质中:因为O2-能存在,而H+会与固体电解质中O2-结合构成水
负极:2H2-4e-+2O2-=2H2O正极:O2+4e-=2O2-
(2)加减法书写电极方程式:
由甲醇和氧气以及强碱作电解质溶液的新式手机电池。
解析:CH3OH+O2→CO2+H2O……①
但:CO2在碱性环境中不存在,会与OH-反响生成CO32-
CO2+2OH-=CO32-+H2O……②
故将①、②式进行叠加即为总反响:
2CH3OH+3O2+4OH-=2CO32-+6H2O……③
因为正极反响式为:O2+2H2O+4e-=4OH_……④因为电解质溶液为碱性,所以正极的产品不再进一步反响,则负极的反响式为总反响方程式减去正极的反响式得到:
2CH3OH+3O2+4OH–3O2-6H2O-12e-=2CO32-+6H2O-12OH-
调整之后得(负极):CH3OH+8OH--6e-=CO32-+6H2O

几种常见的燃料电池
一、氢氧燃料电池
氢氧燃料电池一般是以慵懒金属铂(Pt)或石墨做电极资料,负极通入H2,正极通入O2,总反响为:2H2+O2=2H2O。电极反响特别要留意电解质,有下列三种状况:
1.电解质是KOH溶液(碱性电解质)
负极发作的反响为:H2–2e-=2H+,2H++2OH-=2H2O,所以:负极的电极反响式为:H2–2e-+2OH-=2H2O;
正极是O2得到电子,即:2O2+4e-=2O2-,O2-在碱性条件下不能独自存在,只能结合H2O生成OH-即:2O2-+2H2O=4OH-,因而,正极的电极反响式为:O2+H2O+4e-=4OH-。
2.电解质是H2SO4溶液(酸性电解质)
负极的电极反响式为:H2–2e-=2H+
正极是O2得到电子,即:O2+4e-=2O2-,O2-在酸性条件下不能独自存在,只能结合H+生成H2O即:O2-+2H+=H2O,因而正极的电极反响式为:O2+4H++4e-=2H2O
3.电解质是NaCl溶液(中性电解质)
负极的电极反响式为:H2–2e-=2H+
正极的电极反响式为:O2+H2O+4e-=4OH-
阐明:
1.碱性溶液反响物、生成物中均无H+
2.酸性溶液反响物、生成物中均无OH-
3.中性溶液反响物中无H+和OH-
4.水溶液中不能呈现O2-
二、甲烷燃料电池
甲烷燃料电池以多孔镍板为南北极,电解质溶液为KOH,生成的CO2还要与KOH反响生成K2CO3,所以总反响为:CH4+2KOH+2O2=K2CO3+3H2O。
负极发作的反响:CH4–8e-+8OH-=CO2+6H2OCO2+2OH-=CO32-+H2O,所以:
负极的电极反响式为:CH4+10OH-+8e-=CO32-+7H2O
正极发作的反响有:O2+4e-=2O2-和O2-+H2O=2OH-所以:
正极的电极反响式为:O2+2H2O+4e-=4OH-
阐明:把握了甲烷燃料电池的电极反响式,就把握了其它气态烃燃料电池的电极反响式。
三、甲醇燃料电池
甲醇燃料电池以铂为南北极,用碱或酸作为电解质:
1.碱性电解质(KOH溶液为例)
总反响式:2CH3OH+3O2+4KOH=2K2CO3+6H2O
正极的电极反响式为:3O2+12e-+6H2O=12OH-
负极的电极反响式为:CH3OH-6e-+8OH-=CO32-+6H2O
2.酸性电解质(H2SO4溶液为例)
总反响:2CH3OH+3O2=2CO2+4H2O
正极的电极反响式为:3O2+12e-+12H+=6H2O
负极的电极反响式为:2CH3OH-12e-+2H2O=12H++2CO2
阐明:乙醇燃料电池与甲醇燃料电池原理根本相同
四、铝–空气–海水电池
我国创始以铝–空气–海水电池作为动力的新式海水标志灯,以海水为电解质,靠空气中的氧气使铝不断被氧化而发作电流。只要把灯放入海水中数分钟,就会宣布耀眼的白光。
电源负极资料为:铝;电源正极资料为:石墨、铂网等能导电的慵懒资料。
负极的电极反响式为:
4Al-12e-=4Al3+;
正极的电极反响式为:
3O2+6H2O+12e-=12OH-
总反响式为:4Al+3O2+6H2O=4Al(OH)3
阐明:铝板要及时替换,铂做成网状是为了增大与氧气的触摸面积。