锰基化合物在化学电源中的优势与潜力
摘要:当时化学电源中的正极资料大都运用过渡元素氧化物或其衍生物,而锰基资料更具优势。在化学电源中运用最广的是MnO2,如锌/碳电池,碱锰电池,可充碱锰电池。对各类晶型MnO2结构研讨较为透澈,又可相互改动,并可制备Li-Mn-O化合物:如尖晶石型LiMn2O4和层状结构的LiMnO2和层状-层状复合物是动力锂离子电池的候选资料。与LiCoO2比较较,Mn-基资料的优势是:资源丰厚,价格低价,环境友好,安全性强。
关键词:MnO2电池;层状锂-锰-氧化物;尖晶石型锂-锰-氧化物
当时有用化学电源中的阴极,简直都运用金属氧化物或其衍生物作为活性资料。而很多的电池系统中,以二氧化锰作为活性资料的最多。如一次电池中的锌碳电池、碱锰电池、锂-锰电池。贮备电池水激活锌锰电池中的MnO2。二次电池中有可充碱锰电池,锂合金可充电池的MnO2,以及在锂离子电池正在大力研制的锰基衍生物如LiMnO2、Li2MnO3、LiMn2O4等。
1 MnO2作为电极资料的优势
MnO2是一种多晶型资料,跟着制备条件的不同,可有不同的晶型、形状、粒径、孔隙率、比外表积,而适用于不同的运用场合。既可用于一次电池中,又可用于二次电池中。既可用于水溶液(弱酸性或碱性)中,也可用于有机溶剂中,既可作为可充电池的正极活性资料,又可作为超级电容器或电化学电容器的活性资料。其运用之广,在许多电池正极活性资猜中是罕见的,并且MnO2的研讨跟着运用的需求,功能也在与时具进。
1.1 MnO2的晶型彼此间可相互转化
二氧化锰的晶体结构可分为三大类,存在5种主晶和30余种次晶。但其根本结构单元是由1个锰原子与6个氧原子配位组成的六方密堆积或立方密堆积结构[MnO6]八面体,八面体与附近的八面体共棱或共角顶即构成改变无常的杂乱网络,这些网络又可包容各种不同的阳离子或水分子,就构成多种多样不同类型的晶体结构。在结构中把未被占有的八面体晶格点构成平行于C轴的空地(或空位)界说为地道。地道用T[m×n]标明其巨细(T为地道结构,m是地道高度,n为地道宽度)。据此可将MnO2的晶体结构分为三大类:即一维地道结构[1×1]的β- MnO2(软锰矿);由软锰矿和斜方锰矿[1×2]交互成长构成的γ- MnO2,和[2×2]的α- MnO2(碱硬锰矿、隐钾锰矿、铅硬锰矿、水钠锰矿、杂硬锰矿、钦镁锰矿等具有不同阳离子);具有层状结构的二维地道结构的δ-MnO2。层间含有不同阳离子或水分子而有层距离不同的次晶(如组成钠水锰矿和水锰矿),以及衍生物Li-Mn-O层状物(LiMnO2、Li2MnO3…);具有网状结构的三维地道的λ-MnO2及Li-Mn-O的衍生物的LiMn2O4等等。
而这些不同晶体结构的MnO2及其衍生物在必定条件下发作晶型互变如图1所示。图中晶型的互变转化条件拜见已宣布的文章[1]。

图1 二氧化锰及其相关锂锰氧化物晶体结构互变联系
由图1能够看出由α、β、γ、δ-MnO2与斜方MnO2,在必定条件下可改动为尖晶石结构λ-MnO2、LiMn2O4、Li2Mn4O9等,由γ-MnO2可转化为LiMnO2,因此又联系到锂锰氧化物间的互变,而后者正是锂离子电池可供挑选的正极活性资料,然后大大拓宽了锰基资料运用的空间,并且这些锰基氧化物活性资料还比其金属氧化物资料具有共同的优势。
1.2 资源丰厚
锰在地壳中贮量居第12位,在过渡金属元素中只需Fe的贮量超越锰。资源丰厚在考虑用于混合电动车(HEV)和电动车(EV)的电源正极资料是一个重要因素。锰矿出产为MnO2有老练的技能(包含电解法和化学法),这也是MnO2正极活性资料具有的优势。
1.3 价格低价
在一次电池中或二次电池中,很少有比MnO2价格廉价的正极活性资料。从原资料价格,2008年进口的天然锰矿(含锰量43%~45%)到岸价约为590美元/吨(约合4000元/吨),同期出产的电解二氧化锰(EMD)价格约10500元/吨,而进口钴价最高约90万元/吨,因此组成MnO2只需组成LiCoO2的价格的1%左右。而在锂离子电池中的Li-Mn-O资料比起Li-Co-O也要廉价得多。
1.4安全功能优秀
用于电池特别是在HEV或EV中在过充或过放时,锰基正极资料(特别是MnO2)要比LiCoO2或LiNiO2等资料发热量要少,因此从过充到Mn4+时有较其他到Co4+安全或Ni4+的安稳性要好。
1.5 环境友好
锰基资料比Co基资料的毒性来说,是无毒资料,在对环境友好来说也有重要的含义。
2 近十年MnO2电池获得巨大前进
2.1 完成了锌锰电池从锌碳电池、纸板电池到碱锰电池的无汞化的过渡。我国是一次电池的出产大国,产值占国际50%以上。2007年产值达300.7亿只(碱锰电池82亿只);2008年1月-7月产值达225亿只;10年前我国碱锰电池产值仅有5亿只,2008年前7个月产值近90亿只,在这个开展进程中并完成了无汞化。这得益于我国电解二氧化锰(EMD)的技能的前进与产值的激增。纸板电池得益于一般EMD的参加,而无汞化碱锰电池得益于专用级EMD的增加。
2007年锌碳电池级EMD产值达78337吨,而碱锰电池级EMD产值达81542吨,占国际EMD产值的41%以上。
跟着科技的前进,高技能消费电子设备很多进入市场,大多是需求高功率的碱锰电池,这又推动了高功率碱锰电池的研制。
2.2 高功率碱锰电池的成果[1-5]
(1)要有高功率碱锰电池,首要要具有高功率放电才能的晶体结构为γ- MnO2型EMD[6]。并且这种EMD需求从粒径、粒度散布、比外表、微孔面积、微孔体积、孔隙率、孔径、最高开路电压等各种因素的和谐,就要有适合的电解制备条件:改动与调整本来常法的电解条件,使硫酸、硫酸锰的浓度及其浓度比最佳化,电流密度的操控,温度的挑选规模,以及三者的洽谈[7, 8]。此外还有水热法,能够操控电解条件,可别离制得不同的α、β、γ、δ-MnO2,别离用于碱锰电池或非水溶液中的锂锰电池[9];以及运用水热法电解,可出产出有适合的孔结构的高功率EMD[10]。
(2)点评高功率EMD的办法:
Bowden等[11, 12]运用阶跃电位电化学谱(SPECS)测得EMD样品的功率电位图,并将图上高电位(1.45V)处的峰值功率与低电位(1.1V)处的峰值功率之比界说为功率系数。功率系数越大,标明高电位放电时刻越长,功率系数就越大,EMD的高功率功能的γ-MnO2功率系数最好在4.0以上,实际上,界说功率系数是点评EMD的高电压段放电功能。
运用电子顺磁共振测定γ-MnO2参数法。因为γ-MnO2并非化学计量化合物,具有缺点结构,恰当的化学式为: 。在电子顺磁共振(EPR)谱中,有两种信号A和信号B。若MnO2中Mn均为4价,则B的信号宽度为△B0=430mt;因为存在Mn3+,偶极-偶极的交流缩短改动成“Zener”双交流,则信号宽度改动。△B0越大,Mn3+/Mn4+越大,即OH基越多,缺点结构存在的无序性越大,嵌入H+的容量也越大[13]。
。在电子顺磁共振(EPR)谱中,有两种信号A和信号B。若MnO2中Mn均为4价,则B的信号宽度为△B0=430mt;因为存在Mn3+,偶极-偶极的交流缩短改动成“Zener”双交流,则信号宽度改动。△B0越大,Mn3+/Mn4+越大,即OH基越多,缺点结构存在的无序性越大,嵌入H+的容量也越大[13]。
当然高功率碱锰电池是一种归纳工艺,还需求有高功率的无汞锌粉[14],电解液的组成和浓度以及在电池中的含量;各种添加剂的运用,导电资料的挑选;下降内阻特别是各部件间的触摸电阻(尤其是在EMD、石墨和电液三相界面的有用触摸,因此触及正极成形的工艺如混料造粒,打环以及MnO2和石墨的粒径的合作,构成正极结构孔隙率,以供给质子-电子对定位化有疏通的通道[15]);依据不同类型的电池有相应的优化配方等等。进一步进步其功能,仍有较大的研制空间。
近来报道,用低温水热法制得的直径为1~4μm呈海胆状的α-MnO2用于碱锰电池中放电率为50、200、500mA/g放电至0.6V,放电容量别离达280.5、185.9和168.2mAh/g;而比照的EMD的放电容量别离为254.9、121.1和90.2mAh/g,阐明在高电流密度下α-MnO2的放电功能较好[16]。λ-MnO2在碱锰电池中的运用也获得了开展[17]。
2.3 可充碱锰(RAM)电池
从节省一次资源,削减抛弃电池对环境构成的部分污染两方面考虑,研制RAM电池是人们长时刻重视的课题。早在20世纪60年代末就呈现了市售RAM电池,但因为二氧化锰电极的可逆性较差,跟着充放循环作业电压敏捷下降,并且因爬碱严峻而作罢。经过近30年的尽力,至20世纪90年代末,国内外又鼓起RAM电池出产热潮,国外产值达数亿只。首要是经过对EMD(γ-MnO2)的掺杂改性[18, 19],参加金属氧化物如Bi2O3,TIO2(锐钛型),PbO、PbO2、SnO2等(参加的办法包含物理法、化学法和电化学法改性),以及根本弄清了γ-MnO2可逆性差不宜进行2e的反响充放电机理[20, 21],在le反响γ-MnO2放电生成的是可溶MnOOH,而到了2e/2H+阶段充放电生成了非活性的Mn3O4 ,因此若充放电约束在le/1H+内(最好在0.5e/0.5H+),参加有用的改性掺杂物,也可避免2e/2H+阶段Mn3O4的生成[22]。
当然,出产整个RAM电池,还需求负极活性资料,隔阂、电液浓度,特别是充放电的办法的选定。
关于添加剂,近来有了新的开展。咱们曩昔曾用磁场处理γ-MnO2,发现在高电压区的放电量有大的改进[23]。近来经过参加永磁资料粒子如SmCo5、SmCo17等一系列铁磁、亚铁磁、超导资料及其组合物来改性EMD[24]。发现磁性粒子在正极内存在,影响了EMD复原态的晶体结构,相同可避免充放电进程Mn3O4的生成,然后增大了MnO2的放电容量,例如在le/1H+均相复原中,是未加磁性粒子的MnO2放电容量1.5倍;而到2e/2H+区,总放电量是后者的2.0倍。而用于RAM电池中,磁性粒子SmCo17电极15次循环累积充电容量为3.96Ah/g(le/1H+区),放电容量累积为4.67Ah/g,初始放电容量达0.546Ah/g;而未处理的别离为2.144Ah/g,1.865Ah/g和0.466Ah/g;因此加有磁性粒子对电流效率进步和放电容量,循环性都极为有利。
与其他二次电池的活性资料相同,除了掺杂改性外,还可进行外表润饰和包覆,如运用胶体超细石墨包覆MnO2,用于AA型RAM电池中,若包覆量占正极的3.2wt%,内阻为88.2Ω,包覆量0.6wt%内阻为174.2Ω;而未包覆的内阻却是535.2Ω[25]。因为超细碳粒径只需150nm,包覆在活性资料外表,可削减正极中导电石墨的含量,增大了MnO2的装填量,也增大了电池的放电容量[26]。
近年来,在改进RAM电池的可充性,还提出了用脉冲电流电解Mn2+替代直流电解的办法,并下降槽温(60℃-80℃),以获取不同的缺点结构(在MnOn中的n不同)有不同的含水量,发现n在1.957~1.976时循环性最佳[27]。
应该说RAM电池还有开展的空间,比起一次碱锰电池,性价比显着优胜得多。
2.4 各种晶型MnO2在碱液中的可充性
各种晶型的MnO2在碱液中的可充性是不同的。即便同为EMD或CMD同是γ-型MnO2,不相同品其可充性不相同[28],因为γ-MnO2的缺点结构不必定相同。γ-MnO2的缺点结构有两类,一类是Dewolf缺点,相应于金红石型的β-MnO2在斜方锰矿中交互成长的浓度分数(Pt标明);另一类是孪晶缺点,是共棱八面体链锯齿构成长比率(Mt或Tw标明)。在水溶液中嵌H+,最佳的是缺点结构在46%≤Pt≤50%,即交互成长的无序性最大越好。同是γ-MnO2,其缺点Pt与Mt不同,其嵌入H+的动力学有差异而不同,晶型结构不同,或因为地道巨细不同或因为含水量和杂离子的不同也会影响H+/e对的传输,其反响机理也有异,如δ-MnO2充放电进程的均相只在δ-MnO2→MnOOH0.60,嵌入H+超越0.6,即在充放电进程生成Mn3O4或Mn2O3;且因为层间的缩短与层内的胀大不同,而影响其结构的安稳性。λ-MnO2是[1×1]地道构成的三维网络结构,H+的嵌脱不易,因此可充性差。
2.5 MnO2在非水溶液中的可充性
γ-MnO2在非水溶液嵌脱Li+与在水溶液中嵌脱H+恰恰相反,一般应有最大的有序,即其缺点结构参数小,即Mt→0,或Pt→0。例如在Li/MnO2电池中,将EMD加热处理脱水成为HEMD,生成β/γ,挨近β-MnO2而呈有序化[29]。
α-MnO2在嵌Li电池中是研讨的热门之一,因为α-MnO2是[2×2]地道结构,甚或[3×3]地道结构,有嵌Li+的或许。为了嵌Li+有一系列的制备办法:前期的Mn2+的氧化,Mn2O3在H2SO4中的岐化;Li2MnO3在酸中处理,意图是制得不含K+、Ba2+等杂离子而含水量大的α-MnO2 0.15H2O,因为它具有高的热安稳性(490℃)。显着水分子是替代杂离子在地道中安稳α-MnO2的结构。而NH3分子与水分子巨细附近,键合性质相似,因此用NH3气在低温下处理而构成在地道中由NH3与H+构成NH4+,安稳α-MnO2结构的NH3 α-MnO2。从而用水化型α-MnO2 0.15H2O与LiOH混合、枯燥、烧结(300℃)构成Li2O-α- MnO2。再用NH3与Li2O一起混合构成Li2O-NH3-α-MnO2。这些不同的地道分子的α-MnO2,在3.8-2.0V间,电解液为1M LiPF6/EC:DMC(1:1)的Li/MnO2电池中,π=0.2mA/cm2时,放电初始容量均超越了220mAh/g,且在循环20次时,Li2O-NH3-α-MnO2,Li2O-α-MnO2,NH3α-MnO2与α-MnO2 0.15H2O的放电容量别离为223、188、167和123 mAh/g。前面三种α-MnO2的放电曲线并无下降趋势,即大大改进了α-MnO2的充放循环功能[30, 31]。
层状结构δ-MnO2可由Li2MnO3分出而得到Li2O,组成Li/δ-MnO2电池,在i=0.2mA/cm2,3.6-2.4V间充放电,其初始容量约200 mAh/g,而在第8次循环放电容量只需140 mAh/g左右,阐明容量衰减敏捷[32]。
对三维网状结构的λ-MnO2,美国曾拟做Li/λ-MnO2电池替代Li/SO2电池在部队中运用,因为它有较好的低温功能,并且在高电位区优于Li/HEMD(β/γ-MnO2)电池,特别是4V渠道对低温有利[33]。但作为二次Li电池λ-MnO2放电,易发作多相改变而未见有用化。
2.6 MnO2与锰氧化物的运用拓宽
由图1能够看出,各类MnO2的互变以及各种锰基质料如Mn2+化合物、MnO2、Mn2O3、Mn3O4,都可制备EV和HEV的锂离子电池正极活性资料:如尖石晶型,层状,以及层状化合物的复合资料,引人重视。
首要锰基锂离子电池正极资料根本的物理参数和电化学功能如表2所示。锰基化合物的制备办法如表3所示
表2 锰基锂离子电池正极活性资料的物理参数和电化学功能
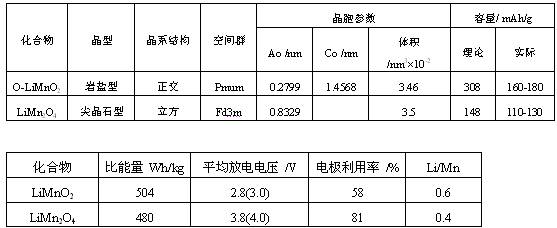
表3 Mn基化合物的制备办法
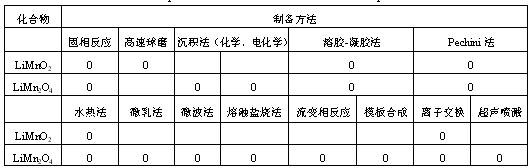
资料必需具有单一的物相,杰出的共同性,均匀的颗粒形状,并有亚微细粒甚或超微的粒子散布,以及大的比外表积。影响其本征性质的是粒子的形状,尺度(粒径),取向、空地、晶粒间界有大的原子分数。这就需求调整制备的条件。相同的制备办法或许有不同的作用。
2.6.1 LiMn2O4的优势与存在问题
LiMn2O4具有尖晶石型三维网络结构。Li+占有四面体(8a)的晶格点,Mn离子占有八面体(16d)的晶格点,氧处于32e晶格点呈敞开式立方密堆积摆放。在Mn2O4构架中晶隙空间可视为四面体8a方位起着Li+搬迁脱嵌的通道。因此适合用作锂离子正极活性资料的本征性质,并且质料丰厚,本钱低价,对环境友好,尤其是热安稳性好,安全性佳,是具有开展潜力的锂离子正极资料。但也因为Mn基资料的固有性质,在充放电循环进程中的容量衰减首要因为Mn的存在而发作。如Mn2+在非水电解液中的溶解丢失;在高电位下,因为Mn3+的岐化Jahn-Teller效应引起结构不安稳的丢失;在高温下,PF与水发作反响构成的HF对电极的腐蚀;跟着充放循环Mn由16d方位移向8a方位阻塞了Li+通道构成的丢失以及发作结构无序化的丢失。这些都与充放进程结构发作改变有关。处理容量衰减的办法大致有:改进组成资料的办法(如表2所示的各种办法)和条件(特别是烧结温度与时刻);对体相的掺杂或替代部分Mn;对资料外表的改性,润饰和处理;或许既替代又外表改性。
(1)体相掺杂替代
掺杂替代的办法有单元或多元阳离子的替代;单元或多元阴离子的替代;阳离子替代Mn和阴离子替代O一起进行。替代掺杂是一种折衷的挑选,有利也会有弊。有的能改进循环,却或许要下降初始容量;有的阳离子替代可进步容量,却可使循环功能变差。多元替代阴阳离子替代或许带来组成的困难或条件的严苛。一切的掺杂替代都有最适量,否则会带来结构的改变。对Mn-基化合物体相改性替代掺杂物如表4所示。
表4 掺杂Mn-基正极活性资料的掺杂替代元素
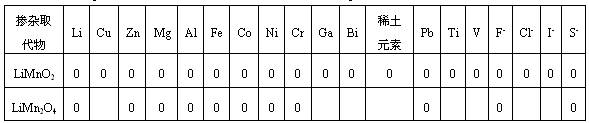
对掺杂改性元素的挑选大致有以下的规则:(1)掺入元素(M)(如Co、Ni、Cr)与O的结合能M-O要比Mn-O的结合能大,使晶胞缩短,缩短M-O键长,进步了LiMn2O4的尖晶石结构的安稳性。但还有不同的特性,如掺Co还能进步Li在体相的分散系数,有助循环功能的进步;如掺Ni优选出替代量为0.5即构成LiNi0.5Mn1.5O4不同制备办法都可使初始容量达135-140 mAh/g,循环数在40-60次规模内,容量丢失在0~4.5%之间;当替代量x在0.05≤x<0.5之间也可达130 mAh/g左右。循环在100次以上容量衰减也只在2~5%之间,这是因为Ni-O键能大,弱化了Li-O键的结合能,下降了Li+分散的内阻。(2)掺杂元素M-O的键能也与掺杂替代元素的离子半径有关。rMn3+=0.0645nm,而rCr3+=0.0615nm,rTI4+=0.0605nm,Cr与TI的离子半径均小于Mn3+的离子半径,因此会使晶胞缩短,结构安稳在循环中不易形变,进步了循环功能,但一般初始容量会下降一些。因此一般要进步循环功能,就要挑选与Mn离子半径附近或稍小的金属离子。(3)要按捺资料的Jahn-Teller效应,一般要挑选+2或+3价的离子,首要是进步LiMn2O4中Mn的均匀价态。但若既要进步循环功能,又有好的比容量,首要应制备单一的物相[34]。Al3+,Ga3+,Fe3+的离子半径与Mn3+相同或附近,但均既占有四面体8a晶格点方位又占有八面体16d晶格点方位,而构成反尖晶石离子LiMn5O8存在,但只需M掺杂量最佳化,也有利循环性的进步[35]。(4)阴离子(F-)替代一般负电性比氧大,吸电子才能强,下降Mn在电液中溶解,使LiMn2O4的初始容量进步,但下降了Mn的价态,容易发作Jahn-Teller效应,循环功能会变坏,因此一般用F替代氧,必须有习惯的阳离子替代Mn加以和谐。
上述准则是以单元替代而言,它们的缺乏能够用多元替代或掺杂来加以改进,例如Ni替代成效显著,但未见高倍率的报道。近来用不同的组成法,用Mg替代部分Ni构成LiMgδNi0.5-δMn1.5O4(δ=0.07)其理论容量为148.7mAh/g,非常挨近未加任何替代的理论容量148.2mAh/g。结果标明Li/LiMg0.07Ni0.43Mn1.5O4在3.5-4.8V间0.2C放电,用固相法,溶胶凝胶法和干凝胶法制得的样品的初始容量别离为116、108和106 mAh/g,1C下别离为104.4、97和95.4 mAh/g;30次循环后以5C率放电别离为70、64.8和74.2 mAh/g,标明倍率才能杰出[36]。又如TI替代Mn,以电解法先制得Ti-EMD,再用固相反响法制得Li0.973Ti0.045Mn1.893O4在2.5-4.6V间放电初始容量达206mAh/g,循环40次后容量坚持率为20%,储存3个月初始容量可达144mAh/g,40次循环后容量坚持率为14%;而储存电池在4.3-3.4V内的充放循环约150次后其容量坚持率达94.7%。即二元替代既有好的初始容量,循环性,更有杰出储存功能[37]。
不少掺杂替代的离子(无论是+2价或高价离子)在室温下有不错的循环性,可是在高温(55℃)高电位(5V)下容量衰减快,循环性下降:一是引起资料的氧的缺点,一是引进入16d方位使紊乱度增大。但掺Cu构成LiCuxMn2-XO4(0.025≤x≤0.1)规模内如x=0.1时,在3-5V电压下初始容量达130mAh/g,随后的循环可安稳在120mAh/g[38]。5V级的资料早已做过研讨如LiCu0.5Mn1.5O4和LiNixCu0.5-xMn1.5O2,它们的长处是运用高电位负极时整个电池也有高作业电压,但仍遭到电解液的约束[39]。
对LiMn2O4的体相改性,尽管作了很多的研讨,获得了一些开展,但对容量衰减的机理并未构成共同的知道,有些试验得出不同的定论,尤其是高功率大电流充放电还未有很好的处理。
(2)LiMn2O4的外表改性。
对LiMn2O4的外表改性应依据运用的要求,或为了进步资料外表电子电导率(如碳包覆),或为了避免资料外表遭到电液的腐蚀溶解(如Al2O3包覆),或为了进步外表的孔隙率以习惯高倍率充放电以延伸循环功能,或为了除掉外表膜层进步活性资料的运用率[40]。
挑选的包覆物应在外表构成均匀的包覆薄层,包覆进程的温度不能损坏资料的结构,包覆办法要尽或许的简洁。现已研讨过的Mn-基资料的包覆物有单质,金属氧化物或其混合物,无机盐,有机物如表5所示。
表5 Mn-基正极活性资料的包覆物

如表5所示,用单质C、Ag等包覆LiMn2O4首要是进步资料的外表电子电导率,镀Ni可进步电极的高温功能[41],用金属氧化物是在资料外表引进M-O(M为金属元素)键,按捺氧的活性和Mn的溶解,进步资料的循环功能。ZrO2的包覆还可进步放电容量[42]。盐类(如Li2CO3等)的包覆可按捺电液中发作的HF对电极资料的腐蚀。LiBO2(LBO)包覆,具有较好的离子电导率,减小比外表积,减缓HF的腐蚀,且在高电压下有用按捺电极与电液的触摸,下降电液的分化[43]。LiCoO2包覆一方面下降了与LiMn2O4电液的触摸,按捺了资料的溶解,并且Co3+可进入16d晶格点位,不光按捺了Jahn-Tellen效应,也削减了Mn3+的岐化,既进步了电极的比容量,也改进了电池的可逆容量[44]。有机物如乙酰丙酮处理LiMn2O4可与其外表上Mn空轨迹成键,使之不再对电液分化起催化作用,按捺了电液的分化,在发作配位成键的一起,还可溶解一些Mn离子构成非电活性的Li2MnO3,因此也可防HF的腐蚀。
LiMn2O4自身以及与电液的热安稳性不相同。跟着电池荷电态的不同引起开端反响温度与反响热不同。在4.3V充电时,反响热达-408.2KJ/mol。此刻的反响温度为151℃[45]。尽管远低于自身在4.3V的240℃,也是较为安全的。
据报道Davidson等组成了LiMn1.5Ni0.5O4,以2.2C放电容量超越了100mAh/g,循环100次后,容量没有显着的衰减,还可进行11C放电[46]。
此外,美国阿贡国家试验室研制了以Li4Ti5O12为负极,LiMn2O4为正极的锂离子电池,具有极高的功率密度,寿数和安全性。循环3000次后容量坚持率达80%;50C放电容量坚持率在低电流放电容量的90%[47],并且证明了尖晶型的Li4Ti5O12 LiMn2O4锂离子电池是最安全的系统[48]。这些目标已挨近或到达混合电动车的要求。
2.6.2 层状LiMnO2
LiMnO2有多种晶型。属层状结构的有α-NaFeO2型的单斜m-LiMnO2和岩盐型呈正方的O-LiMnO2。在热力学平衡条件下,O-LiMnO2比m-LiMnO2安稳些,前者的理论容量达308mAh/g,后者则为285mAh/g,都比LiCoO2要高。但因为Mn3+ 3d电子能带散布(t2geg)的反铁磁相互作用,引起Jahn-Teller效应。使氧的摆放发作畸变,难以构成抱负的密堆积,影响结构的安稳。在充放电的进程,物相改动为尖晶石型结构。因为层状LiMnO2和尖晶石型LiMn2O4的Mn基化合物结构的改变,引起容量的衰减,都是Mn为中心构成,不同的是前者Mn为3价,而后者的Mn均匀氧化态为3.5价。因此,两者的制备办法,对体相的改性和外表的处理润饰,均是大同而有异。若部分Mn被Ni或Co替代,结构呈O2型(O标明八面体氧配位,2标明两层,每单元晶胞为MO2),即结构变稳些,可按捺相变。跟着制备办法和替代离子的不同,还有O3型结构即为氧八面体配位构成3层,或构成氧四面体配位的T2型,或菱形Na+配位的P2型结构。P2型转化为O2型只需MO间相互滑移即可,便是离子交流法的理论依据。在电化学充放电进程,T2也可改动为O2型。如替代构成富Li并Ni替代的层状物,会构成四面体氧配位的T2型结构,这也是在层状LiMnO2中Ni替代Mn成为研讨热门,并具有杰出的容量和循环性的原因。
关于LiMnO2的制备办法,体相改性,和外表润饰已别离在表3、4和5中列出。在体相改性中,值得一提的是构成富锂(或过嵌锂)和缺锂的两类化合物。锂的嵌入,总的来说替代部分Mn,占有Li层中四面体方位,有利于坚持结构的安稳性。当过嵌锂,可进步Mn的均匀氧化态。并按捺Jahn-Teller效应。前期Lu等[49]组成了Li[NixLi(1/3-2x/3)Mn(2/3-x/3)]O2,x=5/12时在3.0-4.4V间以30 mAh/g电流密度放电,容量达150 mAh/g,且安全性优于LiCoO2,容量和循环性都得到进步[50]。Li(Li0.2Ni0.1Co0.2Mn0.5)O2可视为两种层状物的固溶体,也可视为过嵌或替代的层状化合物或超晶格结构的化合物,初始容量可达234mAh/g,40次循环后容量坚持率达98.3%。过嵌锂要适中,或有利于容量,或有利于循环功能的改进。有的富锂如Li[Lix(Ni0.5Mn0.5]O2发现混排度低于LiNi0.5Mn0.5O2;而Li[LixNi1/3Co1/3Mn1/3]O2(0.03≤x≤0.17)比Li(Ni1/3Co1/3Mn1/3)O2的混排度要小,有序性增大,对容量有利。
对缺Li的可转化为O2型,O2-Li2/3+x(Co0.15Mn0.85)O2(x=0, 1/3)两种化合物当x=1/3即为化学计量化合物,当x=0即为缺Li的层状化合物可转化为O2型。O2-Li2/3+x(Co0.15Mn0.85)O2在电流密度5 mA/g时可逆容量均为180 mAh/g,在电流密度140 mA/g即1C下,两种均为100 mAh/g(在2.5-4.6V间)。由EIS研讨标明在循环10~15次后O2(Li+x)的容量衰减增大,这与外表膜构成与体相的电阻增大共同。随后的循环(≤6)次,锂离子分散系数:DLi为2×10-11~10×10-11cm2/S,而O2(Li)为0.5×10-10~3×10-10 cm2/S;即化合物的容量衰减,除了界面动力学外,也与DLi值(即体相内)的改变有关[51]。阐明缺锂化合物对反抗容量衰减有利。此外由Na0.7(Ni1/6Mn5/6)O2经过离子交流法制得Li0.7(Ni1/6Mn5/6)O2是缺锂化合物,在2.0-4.6V间循环没有显着的容量衰减,作者认为是一种面缺点结构[52]。
总归,富Li和缺Li的层状化合物均有较好的功能,是值得重视的课题。Zn、Mg等较大离子半径替代Mn,在Mn3+的价带引进空穴,发作搅扰反铁磁自旋摆放的Mn4+,进步了m-LiMnO2结构的安稳性。Co、Cr、Ni等过渡金属离子半径与Mn3+附近,并占有八面体方位,按捺Jahn-Tellen效应,安稳了层状结构。特别是Ni在层状中替代,有其杰出的功能[53]。
LiMnO2的包覆,与LiMn2O4的包覆机理相似。首要是按捺锰的分化,电解液对电极的腐蚀。金属氧化物的包覆,金属M-O的强度,按捺外表氧的活性或进步Li+分散途径以进步电化学功能等。
2.6.3 层状Li2MnO3的复合
Li2MnO3属岩盐型单斜晶系结构,空间群为C2/m,与LiMnO2不同的是氧不是抱负的密堆积,八面体层中交叠的是Li+与Mn4+层。因为Mn是4价,所以Li2MnO3自身不具电化学活性,Li+也不能脱出,要使之成为正极活性物,办法之一是用3d金属替代部分Mn,使之构成固溶体复合物,而终端产品可视为Li2MnO3与其他层状物的复合物。
层状Li2MnO3可与层状化合物(LiMO2(M=Co、Ni、Fe……等)构成复合物。因为许多LiMO2与Li2MnO3多为同构物,因此研讨过的有(LiCoO2-Li2MnO3,Li1-xNi1-xO2-Li2MnO3,LiCoO2-LiNi0.5Mn0.5O2复合物[54]。这些复合物正极一般都有高电位,高能量密度的特性,因此引起人们的重视。但制备办法和条件都非常严苛,含Co等本钱也贵重。
LiFeO2也是层状化合物,LiFeO2-Li2MnO3复合,Fe、Mn均价廉,因此更吸引人,但立方α-LiFeO2与四方γ-LiFeO2和Li2MnO3都对错电化学活性物,要用Fe部分替代Li2MnO3中的Mn就必须用软化学(低温)法,即H+/Li+交流或Na+/Li+交流制备法,并限制Fe/Mn+Fe之比。早先用Fe替代Li2MnO3的部分Mn,用固相反响法(Fe/(Fe+Mn)<0.3)或水热烧结法(Fe/(Fe+ Mn)<0.75)(650℃<T<700℃)之间制得的复合物中的Fe为3价与4价的混合态。替代样品的充放电功能均差,在2.5-4.8V充放电(烧结温度650℃)其初始放电容量虽有170mAh/g,可是这个容量数值是在低电流密度(7.5mAh/g)下得到的[56]。但近来,作者改动了制备条件[55],用在Fe(NO3)3+MnCl2(Fe/Fe+Mn=0.3-0.7)在-10℃下堆积,再在(LiOH+EtOH)中25℃鼓泡共沉淀,洗刷后,加(LiOH?H2O+KOH+KClO3)在220℃进行水热法处理8h得到Li1+x(FeyMn1-y)1-xO2;再在不同温度下(500-750℃)热处理20h(空气中),洗刷枯燥,得到粒径小于100nm的Li1+x(FeyMn1-y)1-xO2,该终端产品在y=0.5时由0.6层状岩盐型和0.4立方岩盐型物相组成。在650℃-750℃下热处理样品样品最佳,此刻Li/(Fe+Mn)在1.45-1.50之间,x=0.185-0.20,y=0.5。并且在热处理的温度增大,并未影响Fe/(Fe+Mn)值。结构剖析标明产品由Mn替代LiFeO2(立方)和Fe替代的Li2MnO3具有层状岩盐型结构构成的复合物,以42.5mA/g恒流在2.5-4.8V间充放电,其初始充电容量和放电容量别离大于300和200mAh/g,而充放循环40次后放电容量仍大于150 mAh/g。当y=0.5时初始放电容量达215mAh/g,这种Fe替代的Li2MnO3的电化学功能大有改进,剖析标明是因为产品的粒径小,比外表积增大,Li含量增大[Li/(Fe+Mn)=1.45],以及首要调整了其均匀化学组成有关,这对廉价3V级大型锂离子电池是极有竞争力的,但作为商品化电池正极资料,对随充放循环的容量减仍需加以改进。
因为尖晶石型结构是三维网状,能够想象与层状Li2MnO3的复合物的制备要困难一些,现已研讨的是Li2MnO3与LiMn2O4的复合,制备出xLi2MnO3 (1-x)Li1+δMn2-δO4 (0<x<1, 0≤δ≤0.33)复合物[57],调整Li和Mn之间的组成,而没有其他3d金属的替代,由此可想象构成xLi2MnO3 (1-x)Li1+δMn2-δO4(M=Ni, Co)等层状-尖晶型的复合物。
经过H+与Li+间的离子交流,用H2SO4自Li2MnO3层间移去Li2O[30],首要得到的产品是(1-x)[Li(Li0.33Mn0.67)O2] x(0.67MnO2)或(1-x)Li2MnO3 xMnO2,在聚合物锂电池中以C/15倍率,在2.0-3.8V间充放循环12次后放电容量为155mAh/g。放电曲线标明循环进程中未转化为尖晶石结构,似逐步转化为无定型;随后嵌入的Li+不能进入Li2MnO3,而只能进入MnO2成为LiMnO2,构成xLi2MnO3 (1-x)LiMnO2。由此也可想象构成(1-x)Li2M′O3 xLiMnO2(M′=Ti4+, M=Ni3+、Mn3+)的新式层状与层状结构的复合物,如0.05Li2TiO3 0.95LiMn0.5Ni0.5O2等。
3 定论
锰资源丰厚、廉价低价,对环境友好,安全性又佳,结构研讨较为深化,既可用于一次电池,又可用于二次电池。各种晶型之间又可相互转化,Li-Mn-O化合物-层状的LiMnO2和三维尖晶石型LiMn2O4是动力电池的正极资料的候选者。比较LiCoO2,Mn-基资料既有优势,又有开展潜力。
参考文献
[1] 夏熙. 二氧化锰及相关锰氧化物的晶体结构、制备及放电功能[J]. 电池, 2005, 35(3): 199-203.
[2] 李同庆. 进步碱锰电池功能的研讨开展[J]. 电池, 2002, 32(6): 329-333.
[3] 夏熙. 大电流放电碱锰电池的开展[J]. 电池, 2003, 33(2): 83-86.
[4] 王金良, 陈来茂, 陈永心. 锌锰电池工业现状与开展方向讨论[J]. 电源技能, 2006, 30(2): 89-92.
[5] 马扣祥, 孟良荣, 夏熙. 高功率放电的二氧化锰和电池[J]. 电源技能, 2007, 31(1): 4-8.
[6] 夏熙. γ-MnO2结构模型现状与EMD的功能[J]. 电池工业, 2002, 7(3-4): 169-173.